
Если вы являетесь специалистом в данной области и согласны с условиями доступа, пожалуйста, перейдите в "Режим специалиста" для просмотра.
Снижение риска билиарного литиаза на фоне различных вариантов редукции веса при ожирении
- 16 мин
- 433
- 0
Источник: Медицинский Совет, 2024; (15): 114–124; https://doi.org/10.21518/ms2024-385
Введение
Желчнокаменная болезнь (ЖКБ) является серьезной проблемой здравоохранения в развитых странах [1]. Глобальная распространенность камней в желчном пузыре составляет до 20% у взрослых [2]. Выявление желчных камней само по себе не требует лечения, поскольку у большинства людей камни остаются бессимптомными. Однако примерно у 25% пациентов с билиарным литиазом развиваются симптомы и/или осложнения, и поэтому для них золотым стандартом лечения является (лапароскопическая) холецистэктомия [3, 4].
Классифицируют желчные камни по их локализации (желчный пузырь или желчевыводящие пути) и составу, который определяется физико-химическими изменениями в желчи, дифференцируют их по преимущественному содержанию холестерина, который определяет состав желчных камней до 90% случаев. Остальные 10% представлены черными и коричневыми пигментными камнями, которые в основном состоят из билирубината кальция, комплексов кальция и муциновых гликопротеинов или неконъюгированного билирубина (например, при синдроме Жильбера) соответственно [5].
Группа китайских авторов предложила учитывать 101 фактор риска, связанный с желчнокаменной болезнью, выявленный в ходе изысканий, основанных на продольных исследованиях, включая когортные рандомизированные контролируемые исследования и исследования «случай – контроль». Факторы риска, связанные с патогенезом желчнокаменной болезни, были разделены на немодифицируемые и модифицируемые. Немодифицируемые (генетические) факторы включают возраст, пол, расу и семейный анамнез, тогда как модифицируемые (фенотипические) факторы включают 37 биологических факторов окружающей среды, 25 социально-экологических факторов и 35 физико-химических факторов окружающей среды [6]. Генетические варианты «ответственны» примерно за пятую часть общего риска желчнокаменной болезни [7]. Наиболее часто сообщаемым генетическим фактором риска у людей, выявленным в полногеномных ассоциативных исследованиях, является вариант ABCG8 p.D19H-гепатоканаликулярного переносчика холестерина, гетеродимера АТФ-связывающих кассетных переносчиков [8]. Генетические факторы, безусловно, имеют большое значение для риска образования холестериновых желчных камней, однако анализ пар близнецов показал, что генетические факторы, по оценкам, «отвечают» только за 25% риска желчнокаменной болезни [7], что подчеркивает важность модифицируемых факторов, связанных с окружающей средой. Несколько наблюдений показали, что сложная генетическая основа может играть ключевую роль в определении индивидуальной предрасположенности к развитию холестериновых желчных камней в ответ на раздражители окружающей среды, включая диету [9–11].
Модифицируемые риски составляют комбинацию таких факторов, как масса тела, метаболические нарушения, включая ожирение, гиперинсулинемию, резистентность к инсулину и диабет, или отсутствие физической активности и высококалорийное питание, включая повышенное потребление рафинированных углеводов и насыщенных жиров и сниженное потребление неперевариваемой клетчатки. Кроме того, некоторые лекарства, например эстрогены и прогестерон, могут предрасполагать к билиарному литогенезу [12].
К патогенным факторам относятся избыточное и быстрое поступление холестерина организма в желчь из печени (с последующим перенасыщением желчи холестерином), повышенная кристаллизация холестерина в пузырной желчи, гиперсекреция билиарного муцина и снижение моторики желчного пузыря [13–15]. Повышенный индекс массы тела (ИМТ) сам по себе выступает в качестве хорошо известного фактора риска развития желчнокаменной болезни, особенно у женщин, при этом частота появления симптоматических желчных камней увеличивается на 7–8% [16, 17] с каждой единицей ИМТ. Риск составляет 17% при генетически обусловленном ИМТ и увеличивается при высокой окружности талии и центральном ожирении: оба фактора часто ассоциируются с дислипидемией, особенно гипертриглицеридемией и низкой концентрацией липопротеинов высокой плотности ЛПВП [16–18].
Желчнокаменная болезнь в основном возникает вследствие следующих четырех причин: перенасыщения холестерином желчи, вызванного избыточной секрецией холестерина в печени вследствие генетических факторов; систолической дисфункции стенки желчного пузыря; дисфункции кишечника с избыточным всасыванием холестерина или перенасыщения холестерином, вызванного нарушением печеночной циркуляции желчи, и, наконец, ускоренного роста кристаллов холестерина и твердых кристаллов холестерина. Основной механизм заключается в следующем: печень секретирует холестерин в желчь, а избыточная фракция переносится лецитиновыми холестериновыми пузырьками, внутри которых холестерин высок, имеет сродство и легко агрегируется. Эти везикулы, агрегируясь, в итоге становятся ядрами, инициирующими наибольшую агрегацию камней. Гранулоциты запускаются после образования кристаллов холестерина, которые вытесняют ДНК из клетки и инкапсулируют кристаллы холестерина, а затем отдельные кристаллы агрегируют, образуя более крупные камни. Поэтому перенасыщение холестерином является необходимой предпосылкой образования желчных камней [13, 14].
Нарушение холегенеза на фоне низкокалорийных диет
Еще в конце прошлого века проблема билиарного литиаза на фоне низкокалорийных диет привлекала внимание специалистов. R. Weinsier и D. Ullmann при изучении доступных источников информации выявили, что, несмотря на потенциальную пользу для здоровья от снижения веса, очень низкокалорийные диеты увеличивают риск формирования кристаллов холестерина и образования желчных камней, который зависит от степени ограничения калорий, скорости снижения веса и продолжительности диетических ограничений. Таким образом, более быстрые темпы снижения веса в течение длительных периодов времени связаны с повышенным риском билиарного литогенеза. Доступные данные, полученные в результате проспективных исследований пациентов во время активного снижения веса, демонстрируют, что вновь образовавшиеся камни в желчном пузыре возникают уже в течение 4 нед., а частота встречаемости в 15–25 раз выше, чем в общей популяции, страдающей ожирением. Камни вызывают симптомы примерно у трети пациентов, из которых почти половина впоследствии подвергается хирургическому вмешательству [19].
Диетические привычки определяют качество и количество потребляемой энергии и играют ключевую роль в возникновении и дальнейшем развитии метаболических нарушений. Типичная западная диета (гиперкалорийная, с высоким содержанием рафинированного сахара, низким содержанием клетчатки, высоким содержанием липидов) увеличивает вероятность желчнокаменной болезни [20]. Снижение веса уменьшает риск образования камней в желчном пузыре, за исключением двух особых случаев: чрезвычайно быстрой потери веса (т. е. > 1,5 кг/ нед) и чрезмерного снижения веса (т. е. > 25% массы тела) [21, 22]. В обоих этих случаях риск образования камней в желчном пузыре возрастает [23]. Например, R. Liddle исследовал развитие желчных камней в течение 8-недельной низкокалорийной диеты у 51 пациента с ожирением и у 26 субъектов контрольной группы, не соблюдающих диету. Через 8 нед. диеты у 3 человек был обнаружен билиарный сладж, а камни в желчном пузыре – у 13 (25,5%). Напротив, ни у одного из субъектов контрольной группы не наблюдалось каких-либо заметных нарушений со стороны желчного пузыря. Во время диеты у 1 из 51 испытуемого развились симптомы желчной колики, что привело к холецистэктомии. После прекращения диеты и восстановления нормального питания еще у двух пациентов с камнями развились симптомы, достаточно серьезные, что привело к холецистэктомии.
J. Marks et al. наблюдали за девятью пациентами с ожирением, которые придерживались диеты с калорийностью 520 ккал, пузырную желчь собирали из двенадцатиперстной кишки перед началом и семь раз в течение первых 56 дней диеты. Индекс насыщения желчи холестерином и уровни арахидоната, простагландина Е2 и гликопротеина значительно увеличились, время нуклеации уменьшилось, и общая концентрация липидов не изменилась. Появлению кристаллов холестерина предшествовало уменьшение времени нуклеации. Значительному (р <0,05) повышению уровня простагландина Е2 предшествовало выраженное повышение уровня арахидоната, за которым следовало значительное повышение уровня гликопротеина с примерным риском 30 и 25% соответственно [13, 24–26]. Во время снижения веса с помощью очень низкокалорийных диет (ОНКД), содержащих менее 800 ккал в день [27], увеличивалась частота образования желчных камней. Предложено несколько патогенетических механизмов: повышенное насыщение желчи холестерином, усиление секреции желчным пузырем муцина и кальция, повышенное содержание простагландинов и арахидоновой кислоты. Изменения моторики желчного пузыря могут способствовать образованию желчных камней, но лишь немногие исследования затрагивали вопрос моторики желчного пузыря во время быстрого снижения веса и ее возможную роль в образовании желчных камней. ОНКД были связаны со стазом желчного пузыря как следствие снижения стимуляции желчного пузыря из-за низкого содержания жиров в рационе. Установлено, что пороговое количество жира (10 г) обеспечивает эффективное опорожнение желчного пузыря [28]. Диетические липиды являются медиаторами риска желчнокаменной болезни: ненасыщенные жирные кислоты снижают риск, а насыщенные и трансжиры повышают риск [29]. Циклическое изменение веса (т. е. снижение и восстановление веса) является независимым фактором риска образования камней в желчном пузыре [14]. Колебания веса также увеличивают риск необходимости холецистэктомии: S. Syngal [30] наблюдал, как умеренные (4,5–8,5 кг), так и тяжелые (≥9 кг) колебания в одном весовом цикле увеличивали риск холецистэктомии на 31 и 68% соответственно. Изменения соотношения холестерина и солей желчных кислот в желчном пузыре наблюдались на фоне колебаний веса и при быстром снижении веса [31], что отражает увеличение секреции и синтеза холестерина в печени, а также снижение секреции солей желчных кислот [32]. Также происходит нарушение моторики желчного пузыря, что провоцирует образование билиарного сладжа [33].
Бариатрическая хирургия и риск холелитиаза
Повышенный риск образования камней в желчном пузыре был проиллюстрирован группой авторов не только очень низкокалорийными диетами, но и бариатрической хирургией – двумя популярными методами снижения веса [13]. Гастроэнтерологические постбариатрические осложнения и проблемы автор настоящей работы подробно описал в другой статье, в ней приведена история пациента после рукавной гастрэктомии, который в течение пяти лет имел ряд осложнений: массивный билиарный литиаз, «мягкий» холестаз, синдром избыточного бактериального роста и в итоге декомпенсированный цирроз печени с тяжелыми сепсисом, приведший к смерти [34]. Все эти осложнения можно было предотвратить.
Литогенез изменяется после бариатрической хирургии
Постбариатрические модификации включают гипернасыщение желчи холестерином – за счет мобилизации холестерина из жировых тканей, усиливающей кристаллизацию холестерина, снижение секреции желчных кислот (ограничение калорийности), увеличение продукции муцина (усиление кристаллизации) и, наконец, гипомоторику желчного пузыря (вторично из-за снижения секреции холецистокинина, связанного с гипокалорийной диетой или резистентностью к холецистокинину, связанной с ожирением, гастродуоденальной эксклюзией или интраоперационным повреждением печеночных ветвей блуждающих нервов) [31, 35–39]. Пациенты с ожирением, перенесшие бариатрическую операцию, подвергаются высокому риску образования холестериновых желчных камней. По данным разных авторов, до 40% случаев у бариатрических пациентов развиваются камни в желчном пузыре, а примерно у 8–15% из них появляются симптомы холелитиаза [40–45]. Некоторые исследования показали, что у 3–22% пациентов с ожирением развиваются камни в желчном пузыре в течение 12 мес. после операции, а у 8–30% – в течение 24 мес. после операции [46, 47]. Наряду с этим, в 4,7–12% случаев бариатрическим пациентам требуется холецистэктомия во время активного снижения веса [48].
Большинство желчных камней формируется в течение 6 мес. после бариатрической операции, а холецистэктомию часто выполняют в течение 2 лет [49–51]. Поскольку после бариатрической операции очень быстро образуются холестериновые желчные камни у тех пациентов с ожирением, у которых холецистолитиаз не возникал в предыдущие годы, очевидно, что образование желчных камней у бариатрических пациентов происходит по другим патогенетическим механизмам по сравнению с небариатрическими пациентами.
В некоторых исследованиях изучалась дуоденальная желчь липидного состава желчи у пациентов с ожирением, снизивших вес, в основном посредством диеты [35, 52, 53]. Большинство исследований показали, что индекс насыщения холестерина (ИНХ) желчи дополнительно увеличивается во время снижения веса в зависимости от продолжительности наблюдения [24, 28, 31]. В двух других исследованиях изучались изменения в липидном составе желчи на фоне образования камней в желчном пузыре после бариатрической хирургии [54, 55]. В обоих исследованиях наблюдалось увеличение концентрации желчных кислот у пациентов, у которых после снижения веса образовались камни в желчном пузыре, тогда как концентрация холестерина, фосфолипидов и ИНХ существенно не изменялась.
S. Haal S et al. исследовали липидный состав пузырной желчи у 18 больных желчнокаменной болезнью после бариатрической операции и у 17 небариатрических больных желчнокаменной болезнью: медиана (IQR) возраста 46,0 (28,0–54,0) лет. Забор желчи был произведен при лапароскопической холецистэктомии, ее анализ был произведен с использованием ферментативных и липидомических методик. Авторы выявили более высокую концентрацию общих липидов (9,9 против 5,8 г/дл), желчных кислот (157,7 против 81,5 мМ), холестерина (10,6 против 5,4 мМ) и фосфолипидов (30,4 против 21,8 мМ) у бариатрических пациентов с желчнокаменной болезнью по сравнению с небариатрическими пациентами с желчнокаменной болезнью. Индекс насыщения холестерином существенно не отличался между двумя группами. Липидомический анализ выявил интересную закономерность: повышенное количество липидов было обнаружено в пузырной желчи небариатрических пациентов с желчнокаменной болезнью, самым поразительным было пятикратное увеличение количества триглицеридов. Было обнаружено сопутствующее девятикратное увеличение содержания аполипопротеина B, что позволяет предположить секрецию липопротеинов, богатых триглицеридами (ТРЛ), на канальцевом полюсе гепатоцитов в печени у небариатрических пациентов с желчнокаменной болезнью. Эти данные свидетельствуют о том, что образование желчных камней у бариатрических пациентов происходит по-другому, чем у небариатрических пациентов. Нарушение опорожнения желчного пузыря может объяснить быстрое образование желчных камней после бариатрической операции, тогда как повышенная секреция билиарного ТРЛ может способствовать образованию желчных камней у небариатрических пациентов [56, 57].
Профилактика литогенеза на фоне низкокалорийного питания и после бариатрических операций
Было предложено несколько стратегий профилактики желчнокаменной болезни у пациентов, похудевших при помощи ОНД или перенесших бариатрическую операцию. Хотя некоторые авторы выступают за профилактическую рутинную холецистэктомию, это продлевает продолжительность операции и госпитализации, увеличивает количество лапароскопических разрезов, необходимых для операции, и несет в себе риск осложнений, особенно в популяции с морбидным ожирением [58, 59].
Селективный подход, при котором все пациенты проходили предоперационное УЗИ, а пациенты с камнями в желчном пузыре – сопутствующую холецистэктомию, приводил к более высокой заболеваемости и сегодня не рекомендуется [59, 60]. Подход, при котором лечение проходят только пациенты с высоким риском развития желчнокаменной болезни, невозможен, поскольку исследования не смогли выявить конкретные группы риска в бариатрической популяции для назначения профилактического лечения [13, 61, 62]. Это связано с тем, что риск развития камней в желчном пузыре очень сильно коррелирует со степенью уменьшения веса, которая варьирует в зависимости от пациента и не может быть предсказана заранее. Другие характеристики пациентов, такие как традиционные факторы риска образования камней в желчном пузыре, играют незначительную роль в этой конкретной группе пациентов [13, 55].
Медикаментозной профилактикой симптоматической желчнокаменной болезни при резком снижении массы тела является назначение урсодезоксихолевой кислоты (УДХК). УДХК представляет собой желчную кислоту, принимаемую перорально, которая, как известно, предотвращает образование желчных камней за счет увеличения оттока желчи и снижения ее литогенности. Она хорошо переносится и имеет мало побочных эффектов. Наиболее распространенным побочным эффектом является диарея у 2–9% пациентов [63]. Исследование UPGRADE продемонстрировало, что у пациентов без камней в желчном пузыре перед бариатрической операцией профилактическое применение УДХК в течение 6 мес. после операции значительно снижает частоту возникновения симптоматической желчнокаменной болезни [47].
Роль урсодезоксихолевой кислоты в профилактике литогенеза
УДХК – это природная желчная кислота, которую назначают перорально. Наиболее распространенные побочные эффекты включают диарею, тошноту и кожную сыпь. С другой стороны, у пациентов с первичным билиарным циррозом печени (ПБЦ) были зарегистрированы положительные эффекты лечения УДХК, такие как снижение уровня печеночных ферментов и общего холестерина [64, 65]. А. Hofmann описал фармакокинетику, метаболизм, а также фармакодинамическое действие УДХК, связанные с ее физико-химическими свойствами. УДХК всасывается неполностью из-за ее низкой растворимости в воде. После всасывания она конъюгируется с глицином или таурином и циркулирует с эндогенными желчными кислотами. В обычных дозах (8–10 мг/кг/сут) пул конъюгатов УДХК составляет 30–60% циркулирующих желчных кислот. УДХК метаболизируется кишечными бактериями до литохолевой кислоты, которая не накапливается в циркулирующих желчных кислотах из-за эффективного сульфатирования в печени. Прием УДХК снижает всасывание холестерина в кишечнике, усиливает биосинтез желчных кислот и снижает секрецию холестерина с желчью. УДХК является желчегонным средством, как и все желчные кислоты, но отличается от других дигидрокси-желчных кислот нецитотоксичностью, поскольку имеет меньшее сродство к мембранам и в мицеллярных концентрациях не солюбилизирует мембраны. Хроническое введение урсодезоксихолевой кислоты увеличивает канальцевый транспорт [66]. Соответственно, помимо уменьшения симптомов желчнокаменной болезни, прием УДХК может также оказывать благоприятное метаболическое воздействие у пациентов как на фоне очень низкокалорийной диеты, так и после бариатрической хирургии. Подробные механизмы УДХК до сих пор полностью не изучены, но ее влияние на липиды, метаболизм глюкозы и неалкогольную жировую болезнь печени (НАЖБП) было описано ранее [67]. Микробиом кишечника, в свою очередь, оказывает большое влияние на метаболизм желчных кислот, особенно после бариатрической хирургии [67]. Фактически бо́льшая часть ранних эффектов бариатрической хирургии, например улучшение обмена глюкозы, была связана с изменением профиля желчных кислот.
В доступных источниках информации мы нашли очень много исследований и метаанализов по применению УДХК после БХ, часть из них приведены ниже.
M. Shiffman первоначально включил 1004 пациента в 16-недельную программу жидкой белковой диеты с калорийностью 520 ккал в день. Пациентам давали плацебо или УДХК в дозе 300, 600 или 1200 мг/сут. Желчные камни образовались у 28% (95% ДИ 22–35%) пациентов, получавших плацебо, у 8% (ДИ 5–13%) пациентов, получавших 300 мг/сут УДХК, у 3% (ДИ от 1 до 7%) пациентов, получавших 600 мг/сут УДХК, и у 2% (ДИ от 0,5 до 5%) пациентов, получавших 1200 мг/сут УДХК. Различия между пациентами, получавшими плацебо, и пациентами, получавшими УДХК, были статистически значимыми. Процент УДХК в желчи ступенчато увеличивался с увеличением дозы УДХК. Исследователи сделали выводы, что УДХК в дозе 600 мг/сут высокоэффективна для предотвращения образования желчных камней у пациентов, у которых снижение веса вызвано очень низкокалорийной диетой [23].
В исследовании V. Albaugh увеличение содержания УДХК и ее конъюгатов (глицина и таурина) через месяц после бариатрической операции привело к увеличению общей концентрации желчных кислот. Через 24 мес. после операции повышение уровня желчных кислот происходило главным образом за счет повышения уровня первичных неконъюгированных желчных кислот [68]. Кроме того, исследования показали, что УДХК может изменять метаболизм желчных кислот и липидов, а также улучшает чувствительность печени к инсулину и иммуномодулирующие функции [69–73].
В пяти рандомизированных контролируемых исследованиях изучалось использование УДХК для профилактики желчнокаменной болезни после бариатрических операций различных модификаций, данные которых были объединены в два метаанализа [74, 75]. В них показано, что прием УДХК в течение 3–6 мес. эффективно предотвращает образование желчных камней в течение периода до 24 мес. после бариатрической операции. Относительный риск при анализе назначения лечения составил 0,43 (0,22–0,83) в пользу УДХК [75]. Одно недавнее исследование по изучению эффекта УДХК после рукавной гастрэктомии продемонстрировало аналогичные результаты [40]. Однако основной конечной точкой всех исследований было образование камней в желчном пузыре при УЗИ, а не симптомы или медицинские вмешательства по поводу камней в желчном пузыре. Таким образом, эти исследования не предоставляют однозначных доказательств использования УДХК, поскольку у 60–80% пациентов камни в желчном пузыре остаются бессимптомными [49, 76, 77]. Но поскольку степень уменьшения веса коррелирует с риском развития симптоматической желчнокаменной болезни, эти исследования, вероятно, даже недооценивают положительный эффект УДХК. L. Worobetz et al. в двойном слепом плацебо-ориентированном исследовании изучали профилактику образования желчных камней у 29 пациентов с морбидным ожирением после бариатрической операции у 20 женщин и 9 мужчин в возрасте 43 ± 7,3 года, весом 142,5 ± 31 кг. По данным предоперационного УЗИ и пальпации, во время операции в желчном пузыре не было камней. При микроскопии аспирированной пузырной желчи кристаллы холестерина были обнаружены только у одного пациента. После вертикальной гастропластики 13 пациентов получали УДХК в дозе 1000 мг/сут 3 мес., остальные пациенты получали плацебо, обе группы с ожирением имели одинаковое уменьшение веса на 17% и прошли повторное УЗИ. У шести из 14 пациентов, принимавших плацебо (43%), развились камни в желчном пузыре: у двоих появились симптомы, потребовавшие холецистэктомии. Не было выявлено корреляции между риском развития желчных камней и составом желчи до начала лечения или степенью уменьшения веса. Ни у одного из 10 пациентов, принимавших УДХК, не сформировались желчные камни [39]. А. Desbeaux предлагает при отсутствии камней в желчном пузыре назначать УДХК в дозе 600 мг/сут в течение 6 мес. после любой модификации бариатрических операций во избежание образования желчных камней или сладжа и панкреатобилиарных осложнений [78].
На этапе снижения веса профилактическое применение УДХК показало большие перспективы в снижении образования желчных камней независимо от метода снижения веса, т. е. низкокалорийной диеты или бариатрической хирургии, при этом в рандомизированных контролируемых исследованиях сообщалось о снижении до 58% в отличие от контроля [21, 76, 79–81]. Рекомендуется минимальная доза УДХК 500 мг в день, как показано в клинических исследованиях и метаанализе таких исследований, причем эта доза более эффективна, чем 300 мг в день, в снижении риска образования желчных камней в течение 6-недельного периода, а также через 3–4 мес. [80]. Более высокая доза также не продемонстрировала большей пользы, как показано в рандомизированном исследовании у пациентов, перенесших желудочное шунтирование [76]. В этом исследовании сравнивались три дозы УДХК: 300, 600 и 1200 мг в день в течение 6 мес. Доза 600 мг была наиболее эффективной в предотвращении образования камней в желчном пузыре: частота встречаемости составляла 2 против 13 и 6% у тех, кто получал 300 и 1200 мг соответственно. Эти выводы были подтверждены и более поздними исследованиями [15].
Е. Abdallah et al. провели ретроспективный анализ проспективно собранных данных 406 пациентов (124 мужчины, 282 женщины) со средним возрастом 32,1 ± 9,4 года и морбидным ожирением, перенесших бариатрическую операцию. Больные были разделены на две группы: 1-я – не получавшие профилактического лечения УДХК после БХ, 2-я – получавшие терапию УДХК в течение 6 мес. после БХ. Оценивались характеристики пациентов, продолжительность операции, данные о снижении веса и частоте возникновения ЖКБ через 6 и 12 мес. после операции. Обе группы продемонстрировали сопоставимые демографические данные, процент избыточной потери веса (ИПВ) и снижение ИМТ через 6 и 12 мес. после БХ. У восьми пациентов (5%) в 1-й группе развилась ЖКБ, тогда как в 2-й билиарный литиаз не наблюдался (р = 0,0005). Предоперационная дислипидемия и быстрое снижение избыточного веса в течение первых 3 мес. после БХ были факторами риска, достоверно предсказывающими ЖКБ в послеоперационном периоде. Применение УДХК эффективно снижало частоту развития ХЛ после БХ у пациентов с морбидным ожирением. Дислипидемия и быстрое снижение веса в первые 3 мес. после БХ достоверно предрасполагали пациентов к формированию послеоперационной ЖКБ [82].
T. Nabil et al. разделили 200 пациентов после БХ на две группы. Одна группа получала УДХК в послеоперационной схеме профилактики желчнокаменной болезни по 250 мг два раза в день в течение 6 мес., контрольная группа УДХК не получала. Только у 6% пациентов из первой группы развилась желчнокаменная болезнь по сравнению с 40% в контрольной группе (p < 0,001) [41].
При наблюдении за 717 пациентами после БХ O. Şen et al. разделили их на две группы: в одной пациенты принимали УДХК, другая была контрольной. Исследователи получили почти четырехкратное снижение частоты образования новых камней в желчном пузыре при приеме 500 мг УДХК в день. Результат был впечатляющим, что может указывать на необходимость регулярного приема УДХК после БХ [83].
А. Mulliri et al. проанализированы 11 рандомизированных контролируемых исследований, в которых в общей сложности 2 363 рандомизированных пациента и 2 217 пациентов были в группе УДХК по сравнению с 1 415 рандомизированными пациентами и 1 257 пациентами контрольной группы. Профилактическое применение УДХК было достоверно связано со снижением образования желчных камней (ОШ = 0,25, 95% ДИ 0,21–0,31), симптоматической желчнокаменной болезни (ОШ = 0,29, 95% ДИ 0,20–0,42) и частоты холецистэктомии (ОШ = 0,33, 95% ДИ 0,20–0,55). Авторы сделали выводы, что профилактическое применение УДХК после бариатрической хирургии предотвращает образование желчных камней и симптоматическую ЖКБ, а также снижает необходимость холецистэктомии [84].
D. Magouliotis проанализировал имеющуюся литературу о пациентах с ожирением, получавших УДХК с целью предотвращения образования камней в желчном пузыре после бариатрической операции. Восемь исследований соответствовали критериям включения и включали 1 355 пациентов. Метаанализ случайных эффектов показал меньшую частоту образования желчных камней у пациентов, принимавших УДХК. Анализ подгрупп показал меньшее количество случаев желчнокаменной болезни в группе УДХК в зависимости от различных бариатрических операций, доз введенной УДХК и времени после бариатрического пособия. Нежелательные явления были схожими в обеих группах. В группе УДХК меньшему количеству пациентов потребовалась холецистэктомия. О смертельных случаях не сообщалось. Назначение УДХК после бариатрической операции предотвращало образование камней в желчном пузыре [85].
Еще один метаанализ 14 исследований (3 619 пациентов, 2 292 в УДХК против 1 327 в контрольной группе) провели А. Sharma et al. В анализ были включены пациенты с различными вариантами бариатрических операций. Доза УДХК колебалась от 300 до 1200 мг/сут. Образование желчных камней произошло у 19,3% (8,3% в группе УДХК против 38,1% в контрольной группе). УДХК значительно снижала риск образования желчных камней (14 исследований, 3 619 пациентов; ОР 0,27, 95% ДИ 0,18– 0,41; p <0,001), риск симптоматической желчнокаменной болезни (6 исследований, 2 458 пациентов; ОР 0,30, 95% ДИ 0,21–0,43; p <0,001). Пероральный прием УДХК значительно снижал риск развития камней в желчном пузыре у послеоперационных бариатрических пациентов с 38 до 8%. Применение 500–600 мг УДХК в течение 6 мес. является эффективным, ее необходимо назначать всем пациентам после бариатрической операции [86].
Аналогичные данные получили J. Ying et al., проанализировав 18 исследований, включающих 4 827 участников. Статистические результаты показали, что частота возникновения желчных камней в группе УДХК была значительно ниже, чем в контрольной группе. Кроме того, значительно снизилась частота появления симптоматических желчных камней и холецистэктомии [87].
С этими сведениями полностью совпадают данные метаанализа M. Al- Huniti et al., которые изучили 12 рандомизированных контролируемых исследований. В исследованиях, продолжавшихся с 1993 по 2022 г., приняли участие 2 767 пациентов, перенесших различные бариатрические процедуры. Первичным результатом была общая заболеваемость желчнокаменной болезнью, а вторичными результатами были случаи образования желчных камней через 3, 6 и 12 мес., симптоматический холелитиаз и частота холецистэктомии. Этот метаанализ подтвердил эффективность профилактического назначения УДХК для предотвращения образования желчных камней после бариатрической операции. Полученные данные свидетельствуют о том, что прием УДХК снижал не только общую заболеваемость желчнокаменной болезнью, но и частоту симптоматической желчнокаменной болезни и необходимость холецистэктомии [88].
А. Coogan провел оценку 365 500 пациентов, которым были произведены различные бариатрические операции. Пациенты с предоперационной желчнокаменной болезнью были исключены. Первичным результатом была желчнокаменная болезнь в течение 1 года, которую сравнивали между пациентами, получавшими и не получавшими УДХК. Также были проанализированы схемы назначения лекарств. УДХК значительно снижала вероятность развития желчнокаменной болезни, холецистита или холецистэктомии в течение 1 года после бариатрической операции. Несмотря на пользу УДХК, в 2020 г. только 10% пациентов получили на нее рецепт после операции [89].
Клинические практические рекомендации по периоперационному питанию, метаболической и нехирургической поддержке пациентов, перенесших бариатрические процедуры, обновленные в 2019 г., в пункте Р79 «пациенты, перенесшие рукавную гастрэктомию (SG), желудочное шунтирование по Ру (RYGB) или билиопанкреатическое отведение без или с переключением двенадцатиперстной кишки (BPD/DS)» содержат информацию о том, что пациенты подвергаются повышенному риску желчнокаменной болезни из-за быстрого снижения веса. Им рекомендуется пероральный прием урсодезоксихолевой кислоты: 500 мг один раз в день при SG и 300 мг два раза в день при RYGB или BPD/DS (уровень рекомендаций A; уровень доказательности 1) [90].
К сожалению, в отечественной доступной литературе рекомендации по назначению УДХК после бариатрических операций мы не обнаружили. При этом количество бариатрических операций в отечественной практике растет.
Большое внимание в отечественной фармацевтической практике привлекает препарат УДХК Эксхол® («Канонфарма продакшн», Россия). Препарат выпускается в форме капсул по 250 мг, таблеток, покрытых пленочной оболочкой, по 500 мг, суспензии для приема внутрь во флаконе 250 мл (250 мг/5 мл). Последняя форма очень актуальна не только для педиатрической практики, но и для пациентов, имеющих проблемы с проглатываем капсул и таблеток. Форма в суспензии просто незаменима для пациентов после бариатрических операций. Первые два месяца этим пациентам можно принимать только жидкую и пюрированную пищу [90], поэтому жидкая форма для них самая удобная, т. к. УДХК необходимо продолжать принимать в первые дни после операции. В дальнейшем у этих пациентов иногда возникают проблемы с глотанием твердой и жесткой пищи [91], в т. ч. и таблетированных препаратов, поэтому продолжение приема суспензии УДХК, которая очень легко дозируется, очень своевременно и актуально.
Мы провели исследование по установлению фармацевтической эквивалентности дженерических препаратов Эксхол® и Урсофальк®, который является референтным препаратом в России, т. к. оригинальный препарат недоступен. В работе использовали однолучевой интерференционный (с обратным преобразованием Фурье) ИК-спектрометр ФСМ-1202 («Инфраспек», Россия). Параметры записи спектров: диапазон длин волн 4000– 400 см-1, разрешение 4 см-1, циклическая запись с количеством сканов 25.
Фоновый спектр (воздух) получали непосредственно перед записью каждого спектра испытуемого образца. Управление прибором и обработку спектров осуществляли с использованием программы Fspec (версия 4.0.0.2 для Windows®,ООО «Мониторинг», Россия). ИК-спектры изучаемых препаратов представлены на рис. 1. Исследованные нами образцы имели идентичные инфракрасные спектры, что указывает на полную фармацевтическую эквивалентность исследованных нами препаратов УДХК.
Изучение фармакокинетической эквивалентности (биоэквивалентности) указывает на полную биоэквивалентность таких препаратов, как Эксхол® и Урсофальк®1 [92], что также подтверждает результаты нашего исследования (рис. 2).
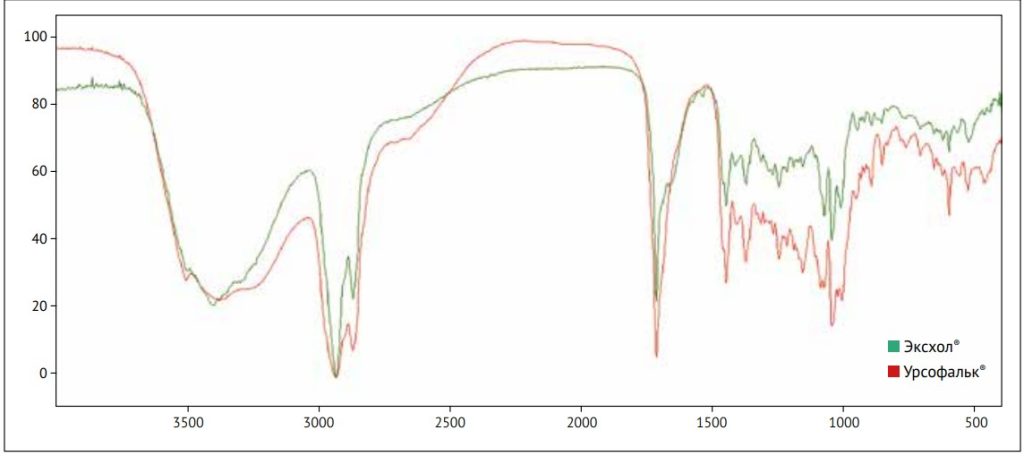
Рисунок 1. ИК-спектр образцов препаратов урсодезоксихолевой кислоты
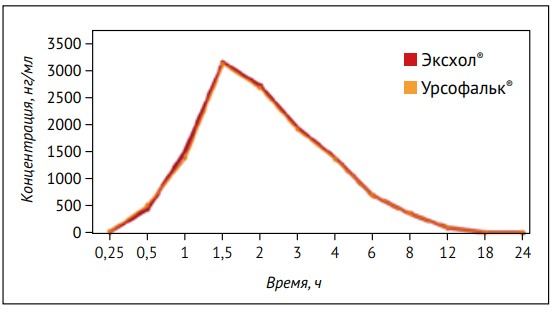
Рисунок 2. Усредненная концентрация урсодезоксихолевой кислоты в плазме крови (нг/мл) при приеме внутрь капсул препаратов Эксхол® и Урсофальк®, 250 мг
Заключение
Таким образом, литогенез изменяется на фоне продолжительных очень низкокалорийных диет и после бариатрической хирургии. Риск образования желчных камней максимален в период быстрого снижения массы тела, особенно в первые 6 мес., независимо от типа бариатрической операции. Этот риск снижается после стабилизации веса пациента. Во всех случаях быстрого снижения массы тела необходимо назначение урсодезоксихолевой кислоты (Эксхол®) в течение не менее 6 мес. после операции. Если же курс приема УДХК будет продолжен, то риск развития позднего билиарного литиаза и других проблем типа дислипидемии будет сведен к минимуму.
Литература
- Portincasa P, Di Ciaula A, Bonfrate L, Stella A, Garruti G, Lamont JT. Metabolic dysfunction-associated gallstone disease: expecting more from critical care manifestations. Intern Emerg Med. 2023;18(7):1897–1918. https://doi.org/10.1007/s11739-023-03355-z.
- Everhart JE, Ruhl CE. Burden of digestive diseases in the United States Part III: Liver, biliary tract, and pancreas. Gastroenterology. 2009;136(4):1134–1144. https://doi.org/10.1053/j.gastro.2009.02.038.
- Portincasa P, Ciaula AD, Bonfrate L, Wang DQ. Therapy of gallstone disease: What it was, what it is, what it will be. World J Gastrointest Pharmacol Ther. 2012;3(2):7–20. https://doi.org/10.4292/wjgpt.v3.i2.7.
- Attili AF, De Santis A, Capri R, Repice AM, Maselli S. The natural history of gallstones: the GREPCO experience. The GREPCO Group. Hepatology. 1995;21(3):655–660. https://doi.org/10.1002/hep.1840210309.
- Schafmayer C, Hartleb J, Tepel J, Albers S, Freitag S, Völzke H et al. Predictors of gallstone composition in 1025 symptomatic gallstones from Northern Germany. BMC Gastroenterol. 2006;6:36. https://doi.org/10.1186/1471-230X-6-36.
- Wang X, Bai Y, Yu W, Xie L, Li S, Jiang G et al. New Progress in Longitudinal Research on the Risk Factors for Cholelithiasis. Sichuan Da Xue Xue Bao Yi Xue Ban. 2024;55(2):490–500. (In Chinese.) https://doi.org/10.12182/ 20240360508
- Полный список литературы: https://doi.org/10.21518/ms2024-385




0 комментариев
Комментарии проходят модерацию по правилам журнала